МОСКВА, 1 фев — РИА Новости, Владислав Стрекопытов. Прошедший год — рекордный по количеству исследований в области CAR-T-терапии. Лечение рака с помощью модифицированных иммунных клеток — метод сложный и дорогой, но есть надежда, что в будущем он станет одним из главных в борьбе с онкологическими заболеваниями. О перспективах нового подхода и последних достижениях ученых — в материале РИА Новости.
Лекарство из собственных клеток
Многие десятилетия рак лечили стандартно: хирургия, радиационная терапия, химиотерапия. В последние годы добавилась иммунотерапия — когда задействуют собственную защитную систему организма, но усиливают ее, используя определенные приемы.
Один из них — CAR-T метод. По сути, это индивидуальная генная терапия, где в качестве препарата выступают модифицированные иммунные клетки больного.
В основе — усиление активности Т-лимфоцитов, отвечающих за обнаружение и уничтожение поврежденных, зараженных вирусами и опухолевых клеток. Одни виды лимфоцитов нацелены на распознавание опасных клеток по специфическим белкам — антигенам. Другие выделяют токсичную смесь молекул для их уничтожения — антитела. Таков общий механизм иммунного ответа.
Но в случае с опухолевыми клетками он не всегда срабатывает. Для опознания антигенов на поверхности иммунных клеток есть специальные белковые комплексы — Т-клеточные рецепторы (ТКР). Взаимодействуя с молекулами антигенов, ТКР активируют Т-лимфоциты. Проблема в том, что раковые клетки хорошо маскируются, естественные Т-клеточные рецепторы часто их не замечают — и опухоль беспрепятственно разрастается.
Несколько лет назад ученые разработали технологию генетической модификации, при которой естественные ТКР заменяют на химерные антигенные рецепторы (CAR) из синтетических белков, нацеленные на конкретные антигены. CAR не только обнаруживают опухоль, но и связываются со специфическими молекулами на поверхности раковых клеток, действуя как антитела.
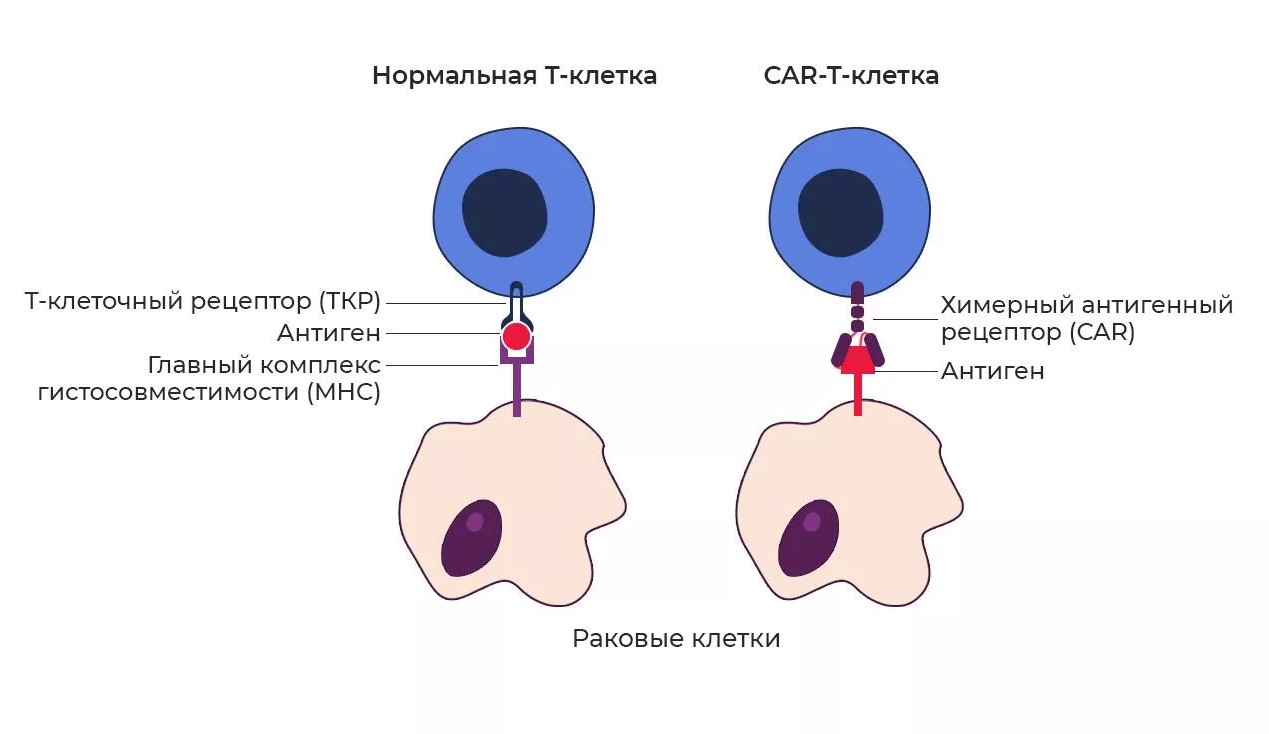
© Иллюстрация РИА Новости
Взаимодействие нормальной (слева) и модифицированной Т-клетки с раковой клеткой. Рецепторы Т-лимфоцитов (ТКР) реагируют не на сами антигены, а на включающую их более крупные белково-углеводные постройки на клеточной мембране — главный комплекс гистосовместимости (MHC — major histocompatibility complex). Раковые же клетки научились обходится без MHC-комплекса. Химерные рецепторы (CAR) взаимодействуют непосредственно с антигеном
Технически процедура CAR-T-терапии выглядит так. У пациента берут кровь и выделяют Т-лимфоциты. В них встраивают ген, кодирующий рецепторы специфических антигенов конкретного вида рака. Т-клетки с искусственными химерными рецепторами антигена (CAR-Т-клетки) выращивают в лаборатории и вводят обратно пациенту.
Преимущество CAR-Т-клеток по сравнению с другими традиционными агентами иммунотерапии (моноклональными антителами или малыми молекулами) заключается в том, что они со временем не исчезают, а, наоборот, размножаются, постепенно замещая остальные белые кровяные тела.
Первые успехи метода
В 2017-м Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) выдала первое разрешение на использование модифицированных Т-клеток с химерными антигенными рецепторами для борьбы с лейкемией. Сейчас одобрены пять различных вариантов CAR-T-терапии — все против различных форм рака крови. Лечение уже получили более 20 тысяч человек, но это капля в море по сравнению с общим числом онкологических больных.
Клинические испытания CAR-Т-терапии при опухолях внутренних органов пока не так успешны. Не все пациенты реагируют на лечение. У некоторых сверхреактивный иммунный ответ вызывает тяжелую токсическую реакцию, а иногда и смерть. Даже у тех, кто почувствовал облегчение, рак чаще всего возвращается. Ученые объясняют это сложным строением твердых опухолей и тем, что раковые клетки, видимо, располагают какими-то еще неизвестными механизмами уклонения от иммунной системы.
Но работа продолжается. Сейчас идет более 500 клинических испытаний, а в сотнях научных лабораторий по всему миру исследователи стремятся усовершенствовать метод CAR-T и расширить его возможности.
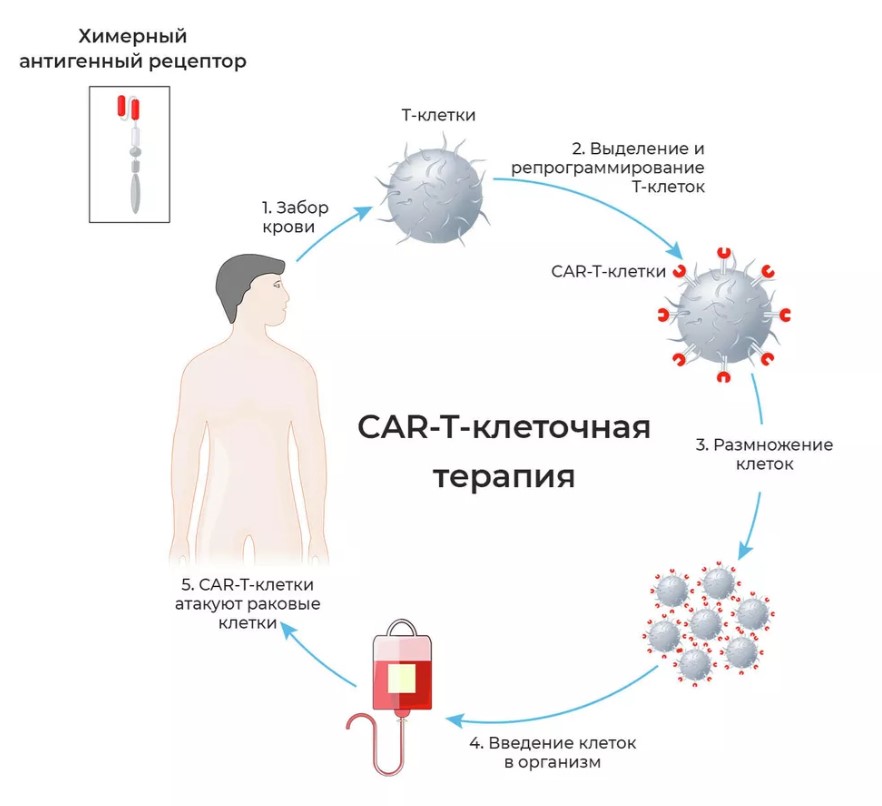
© Depositphotos/edesignua
Схема иммунотерапии рака CAR-T-клетками
Инновации генетического редактирования
Неудачи с применением CAR-T-терапии для лечения рака внутренних органов связаны прежде всего с тем, что модифицированные клетки с трудом проникают внутрь твердой опухоли. А если и удается, то там их нейтрализуют вещества, использующие раковые клетки для подавления иммунного ответа.
Чтобы преодолеть оба препятствия, американские биологи сконструировали Т-клетки, которые можно отключать на время преодоления оболочки опухоли, а потом, когда они окажутся в нужном месте, активировать снова.
"Возможность включать и выключать Т-клетки снижает их истощение, ведь они становятся неактивными после длительной стимуляции, — приводит журнал Nature слова руководителя исследования Эвана Вебера из Медицинской школы Стэнфордского университета. — Предоставление клеткам "периода отдыха" может повысить их общую эффективность против опухолей".
В одном из недавних исследований ученые из Бостонского университета добавили к CAR-Т-клеткам генетический переключатель из 11 последовательностей ДНК. В присутствии определенного препарата он не только активирует их, но и запускает выработку белка интерлейкин-2 (IL-2). А тот, в свою очередь, стимулирует иммунные реакции и противодействует иммунодепрессивным сигналам опухолей.
Другая группа ученых, возглавляемая биологом Венделлом Лимом из Калифорнийского университета в Сан-Франциско, запрограммировала CAR-Т-клетки таким образом, что они начинали вырабатывать IL-2, как только проникают в опухоль. Авторы доказали эффективность такого подхода в лабораторных опытах на мышах с раком поджелудочной железы.
Это один из самых смертоносных видов рака. Несмотря на достигнутые успехи в онкологии, адекватных способов лечения до сих пор нет. Так что в этой сфере у ученых особые надежды на CAR-Т-подход и его сочетание с другими методами.
В частности, немецкие исследователи предлагают комплексный вариант иммунотерапии, предусматривающий использование модифицированных Т-клеток вместе с так называемыми контрольными антителами. Они снимают "тормоза" с иммунных клеток, чтобы те эффективнее боролись с раком.
CRISPR в помощь
Достижения в редактировании генома с помощью механизма "генетических ножниц" CRISPR-Cas9 и разработки, позволяющие перестраивать клетки с помощью методов синтетической биологии, привели к появлению еще более сложных вариантов модификации Т-клеток.
Ученые из Стэнфорда разработали специализированные CAR-T-клетки, нацеленные на молекулу под названием GD2. Она экспрессируется при некоторых видах рака головного и спинного мозга, называемых глиомами. Трое из четырех пациентов, участвовавших в предварительных испытаниях, показали после лечения положительную динамику.
Однако чаще всего твердые опухоли содержат гетерогенную мозаику раковых клеток с различными комбинациями мутаций. Для борьбы с ними нужны модифицированные клетки, которые распознают более одного белка-антигена, но при этом не наносят существенного ущерба здоровым тканям, тоже содержащим данный белок.
В одном из недавних клинических испытаний исследователи использовали CRISPR-Cas9 для модификации естественных рецепторов Т-клеток, способных распознавать различные мутировавшие белки, обнаруженные в опухоли каждого участника. В итоге ученые получили смесь, нацеленную на разные антигены, которая, по их мнению, должна работать лучше, чем узкоспециализированные CAR-Т-клетки.
"Вероятно, это самая сложная терапия, которую проводили когда-либо в клинических условиях, — сказал один из авторов исследования Антони Рибас из Калифорнийского университета в Лос-Анджелесе. — Мы пытаемся создать целую армию из собственных Т-клеток пациента".
В результате у пяти из 16 участников через 28 дней после начала лечения рост опухоли остановился. Авторы планируют продолжить эксперименты — уже с более высокими дозами.
Такой подход, возможно, более эффективный, но при этом весьма затратный. Как и прочие варианты CAR-Т-терапии, он индивидуальный. Сначала нужно провести полное секвенирование ДНК из образцов крови и опухоли пациента, чтобы найти максимальное количество мутаций. Затем с помощью специального алгоритма предсказать, какие мутации с большей вероятностью спровоцируют реакцию Т-клеток. И только после этого приступить к конструированию химерных рецепторов. Это чрезвычайно сложная процедура, иногда она занимает в общей сложности больше года.
"Готовые" клетки для всех
Производство CAR-T-клеток — процесс длительный и очень дорогой. В США только лечение обходится примерно в 500 000 долларов, не считая госпитализацию.
Все одобренные до сих пор методы подразумевают использование собственных Т-клеток пациента. Ученые считают, что стоимость терапии снизит создание "готовых" CAR-T-клеток, которые можно вводить нескольким людям. Но для этого еще многое предстоит сделать.
Прежде всего нужно решить проблему отторжения "неродных" клеток. И здесь свою роль должны сыграть технологии синтетической биологии, которые уже сейчас позволяют создавать системы CAR с точной регуляцией экспрессии и управлять ими с помощью генетических инструментов, активируемых в ответ на определенные лекарства.
Однако до сих пор большинство этих сложных конструкций еще не прошли стандартизацию и проверку на безопасность, необходимые для использования на людях.