Метод перезагрузки. Ученым впервые удалось обратить старение вспять

МОСКВА, 24 янв — РИА Новости, Владислав Стрекопытов. Исследователи из Гарвардской медицинской школы наглядно продемонстрировали, что старение обратимо. Лабораторным мышам вернули молодость с помощью перезагрузки эпигенома — "операционной системы" управления генами. Это принципиально новый подход, открывающий путь к биологическому омоложению, а также лечению болезней пожилого возраста.
Колпачки и часы
Замедлить старение и даже запустить обратный процесс — в последнее время это очень актуально. Эксперименты на животных обнадеживают, но для оценки результатов нужны объективные критерии.
Сначала показателем биологического возраста считали количество накопленных в ДНК мутаций, которые со временем могут нарушить нормальное функционирование клеток привести к их гибели. Но подход себя не оправдал: выяснилось, что число мутаций не коррелирует с общим старением организма. Позже в качестве маркеров старения пытались использовать длину теломер — защитных "колпачков" на концах хромосом, которые укорачиваются при каждом делении клетки. Однако и этот метод оказался неточным.
В последние годы ученые предложили несколько принципиально новых подходов к оценке биологического возраста. Самый известный — эпигенетические часы. Первым его сформулировал в 2013-м профессор Стив Хорват из Калифорнийского университета в Лос-Анджелесе.
Профили старости
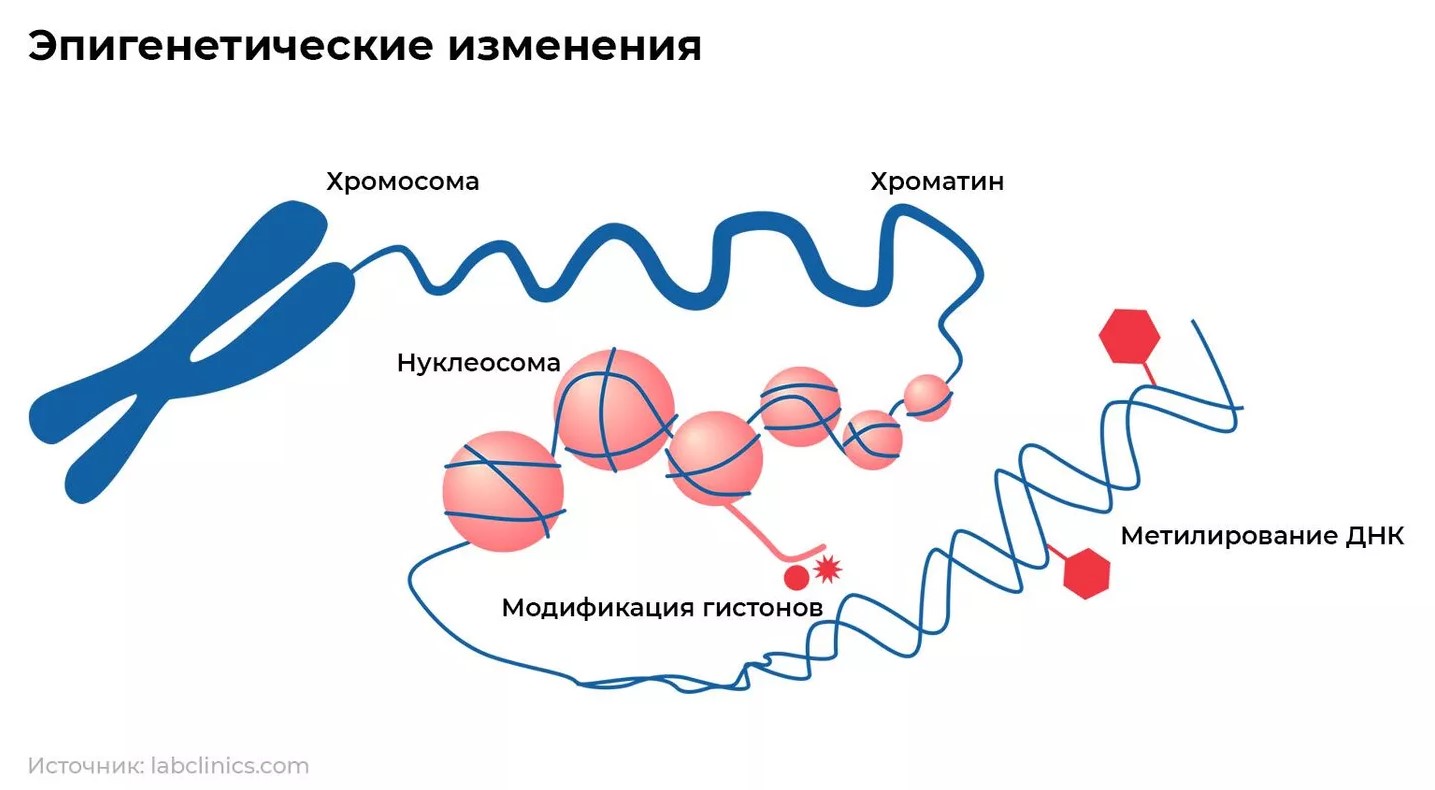
Изучая геном — совокупность наследственного материала, заключенного в каждой клетке человека и других млекопитающих, ученые так и не нашли ни одного гена, который напрямую влияет на продолжительность жизни. Структура ДНК остается постоянной, но меняется активность отдельных генов, что отражается в синтезе белков.
Регулируют этот процесс особые эпигенетические (буквально "надстроенные над генами") молекулярные метки, которые модифицируют ДНК, не меняя саму последовательность нуклеотидов. Лучше всего изучены те метки, что возникают в процессе метилирования — присоединения к молекуле ДНК метильной группы.
Хорват предположил, что с возрастом профиль метилирования меняется, и составил список из 353 метильных меток, по наличию или отсутствию которых можно судить, насколько клетка близка к эмбриональному или, наоборот, сенесцентному, то есть старому состоянию. Переход между двумя крайними профилями эпигенома — множества молекулярных меток — получил название "эпигенетический дрейф".
© Иллюстрация РИА Новости
Назад в молодость
Биологи в деталях изучили механизмы преобразования эмбриональных стволовых клеток сначала в зрелые соматические, отвечающие за определенные функции, а затем в сенесцентные, отмирающие. И всегда мечтали запустить этот процесс в обратном направлении, в сторону омоложения.
Впервые в опытах на лабораторных животных это удалось в 2006-м японцам Синъе Яманаке и Кадзутоси Такахаси. С помощью четырех белков, которые потом назовут "коктейль Яманаки" — Oct4, c-Myc, Sox2 и Klf4, они возвратили дифференцированные соматические клетки (фибробласты из кожи мыши) в плюрипотентное состояние.
В одном из последующих исследований гены этих четырех белков встроили в организм взрослых мышей и, активировав на некоторое время, омолодили целую популяцию животных. Позднее Яманака смог вернуть клетки взрослого человека в эмбриональное состояние. В 2012-м за свои открытия японский ученый получил Нобелевскую премию по биологии и медицине.
Но задача заключалась не только в том, чтобы уменьшить биологический возраст клеток: важно, чтобы после перепрограммирования они сохранили свои функции. И здесь должна была помочь эпигенетика — именно эпигенетические метки активируют или, наоборот, отключают определенные гены, тем самым определяя специализацию, идентичность клеток. Благодаря этому одни стволовые клетки превращаются в нейроны мозга, другие — в клетки кожи и так далее.
Старение — это потеря информации
Недавно американские ученые из Гарварда под руководством профессора Дэвида Синклера опубликовали в журнале Cell статью под названием "Потеря эпигенетической информации как причина старения млекопитающих", которая стала итогом 15 лет работы.
Еще в 2008-м они обнаружили, что при нарушениях ДНК происходят эпигенетические модификации, которые заставляют белки хроматина — главной составляющей хромосом — перемещаться туда, где необходима репарация. Затем, используя современные методы секвенирования, исследователи установили, что релокация белков — модификаторов хроматина к местам разрывов ДНК вызывает разрушение "эпигенетического ландшафта". Другими словами, если сбои в ДНК происходят часто, постоянные "ремонты" приводят к накоплению эпигенетических изменений и в конечном итоге — к потере клеткой своей идентичности. Этот подход получил название информационной теории старения.
"В основе старения лежит информация, которая теряется в клетках, а не просто накопление повреждений, — отмечает Синклер. — Это сдвиг парадигмы".
Перезапуск программы
Ученые предположили, что восстановление утраченных эпигенетических "инструкций" может вернуть клеткам молодость, подобно тому как перезапуск программы на компьютере очищает ее от накопившихся ошибок.
В лабораторных экспериментах они имитировали старение эпигенома, внося разрывы в ДНК молодых мышей. Уже через несколько недель такого "состаривания" у животных поседела шерсть, ухудшились зрение и память, снизилась активность, они потеряли в весе. Эпигенетические часы показали, что модифицированные мыши стареют примерно в полтора раза быстрее, чем обычно.
Затем биологи с помощью факторов Яманаки активировали у животных гены, отвечающие за идентичность клеток, — и после пяти недель проявились заметные признаки омоложения как на молекулярном, так и на тканевом уровне.
"Если бы причиной старения было накопление мутаций, вернуть молодость было бы невозможно, — объясняет профессор. — Но демонстрация того, что мы способны обратить процесс вспять, показывает: система не повреждена, где-то существует резервная копия, и "программное обеспечение" можно перезагрузить".
Авторы отмечают, что их метод принципиально отличается от подхода, основанного на использовании стволовых клеток: он не возвращает клетки в плюрипотентное состояние, не стирает заложенную в них эпигенетическую информацию, а только обновляет ее.
Дойдет до человека
Ученые пока не знают, будет ли аналогичный процесс омоложения работать у людей. Сейчас систему тестируют на приматах, а также проводят лабораторные испытания с клетками человека — нейронами, фибробластами и клетками кожи.
Наибольшие перспективы для практического применения метода специалисты видят в области офтальмологии — здесь генную терапию можно проводить локально, не затрагивая весь организм. В 2020-м успешно восстановили зрение у стареющих мышей, сейчас тестируют коктейль Яманаки на ослепших от старости обезьянах. Если исследования пройдут успешно и будет доказана безопасность системы, авторы планируют обратиться в Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) за разрешением на проведение клинических испытаний на людях.
Возможно, в будущем открытия команды ученых дадут начало новому направлению в медицине — эпигенетической терапии. Тогда есть вероятность, что множество связанных со старением заболеваний будут лечить путем омоложения конкретных функциональных систем организма.
"Теперь, глядя на пожилых, я вижу не стариков, а людей, чья система нуждается в перезагрузке", — говорит Синклер.
Что же касается общего омоложения, здесь авторы высказываются очень осторожно. Они напоминают, что старение — сложный процесс, связанный со многими факторами. Пока не очень понятно, достаточно ли только перепрограммирования клеток, чтобы вернуть молодость всему организму.
