"Чем злокачественнее, тем эффективнее". Как работает новая терапия рака
МОСКВА, 31 авг — РИА Новости, Владислав Стрекопытов. Ученые представили первую отечественную установку для бор-нейтронозахватной терапии онкологических заболеваний. К клиническим испытаниям приступят летом следующего года. О преимуществах нового метода, эффективного в том числе против неоперабельных опухолей, — в материале РИА Новости.
Точно в цель
Рак возникает из-за измененных клеток, которые бесконтрольно делятся. Если иммунная система вовремя их не распознает, опухоль разрастается, в органах и тканях образуются вторичные очаги патологии — метастазы, приближающие летальный исход
Полное удаление опухоли хирургическим путем возможно не всегда. Кроме того, даже после удачной, на первый взгляд, операции нередки рецидивы, обнаруживаются скрытые метастазы. В этом случае медики вынуждены прибегать к лучевой и химиотерапии, поражающим и здоровые клетки и ткани.
Задача ученых — повысить точность воздействия, разработать так называемые таргетные методы. Один из вариантов — использовать энергию ядерных реакций.
Ядерный взрыв внутри клетки
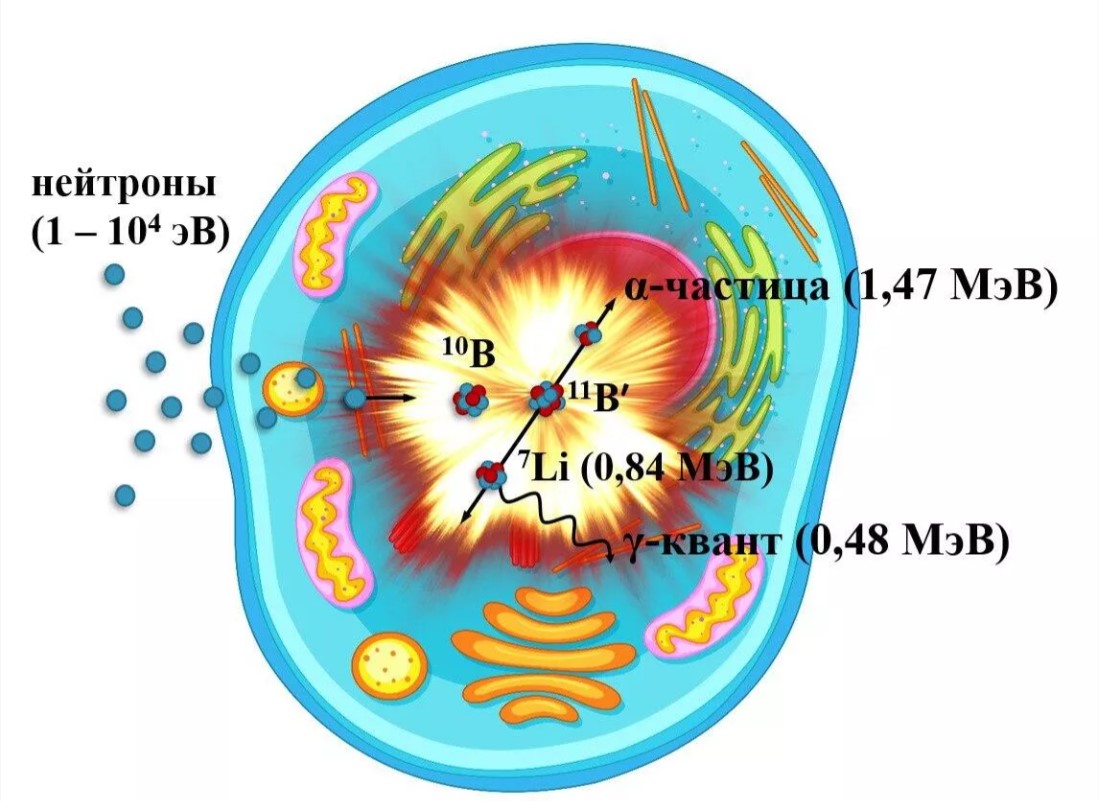
В 1932-м британский физик Джеймс Чедвик открыл нейтрон. Вскоре выяснилось, что ядра бора-10 обладают удивительной способностью захватывать медленные (тепловые) нейтроны, распадаясь в результате на ядра лития-7 и гелия-4 (альфа-частицы). Бор-нейтронный захват (так это назвали) сопровождается выделением энергии, однако вся она рассеивается в радиусе пяти-семи микрон (микрометров). Таков пробег новообразованных частиц.
В 1936-м американский рентгенолог Гордон Лочер, а в 1940-х, независимо от него, советский врач и химик Анатолий Качурин, предложили применить этот ядерный микровзрыв для лечения рака. Размер клетки примерно десять микрон, и если доставить радиоизотопы бора прямо в опухоль, облучить их нейтронами, то окружающие здоровые ткани от микровзрыва не пострадают.
© ИЯФ СО РАН
Схема взаимодействия эпитепловых нейтронов с ядром изотопа бор-10
Проверено в реакторах
В последующие годы исследования продолжили на других реакторах США и Японии. Но имевшиеся тогда препараты не позволяли добиться высокой концентрации изотопа бор-10 в раковых клетках. Сейчас для адресной доставки бора в опухоль применяют борфенилаланин (BPA) и боркаптат натрия (BSH) — безопасные для человека соединения, используемые в качестве контрастных средств для диагностики опухолей на магниторезонансном томографе.
Эксперименты в ядерных реакторах подтвердили эффективность БНЗТ для лечения опухолей мозга и некоторых других видов рака. Но для обычных клиник нужно компактное оборудование. Создать такое оказалось чрезвычайно сложно.
В основе — оригинальная идея
Ученые Института ядерной физики Сибирского отделения РАН (ИЯФ СО РАН) разработали установку на основе линейного ускорителя с литиевой нейтроногенерирующей мишенью. Проект запустили в 1998-м. В 2004-м получили пилотный образец источника. А в 2010-м состоялись первые испытания на клеточных культурах. Сегодня это единственная в мире установка, производящая эпитепловые нейтроны (с энергиями от 0,5 эВ до 10 кэВ) для научных исследований.
Журналистам ее показали во время экскурсии, организованной в рамках инициативы "Научно-популярный туризм" Десятилетия науки и технологий, предусматривающей посещение объектов нацпроекта "Наука и университеты".
"На решение непростой задачи создания мощного источника нейтронов определенного физического диапазона в относительно компактной установке ушло более двадцати лет", — рассказывает руководитель лаборатории БНЗТ доктор физико-математических наук Сергей Таскаев.

© Фото : Пресс-служба Проектного офиса "Десятилетие науки и технологий"
Руководитель лаборатории БНЗТ ИЯФ СО РАН Сергей Таскаев
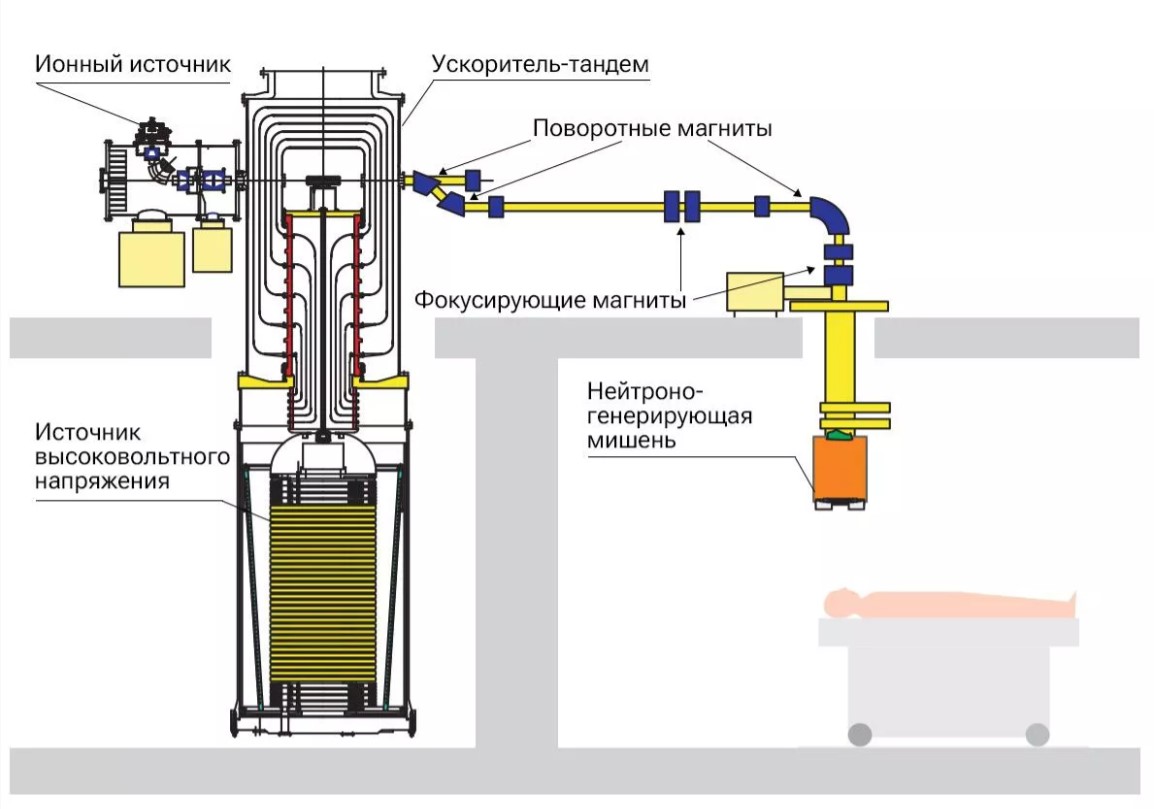
Исходный элемент установки — источник отрицательно заряженных ионов водорода. Пучок от него направляется в ускоритель-тандем, где ионы меняют заряд и разгоняются. Высокоэнергетические протоны, двигаясь в магнитном поле, попадают в мишень — медный диск с литиевым напылением. При столкновении с ядрами лития происходит ядерная реакция, и высвобождаются нейтроны, формирующие терапевтический пучок.
© ИЯФ СО РАН
Схема ускорительного источника нейтронов для БНЗТ, разработанного в ИЯФ СО РАН
"Сегодня в мире около десятка разных типов ускорителей, но ни на одном не удавалось получить протонный пучок большого тока, необходимый для бомбардировки мишени — источника нейтронов с конкретными энергетическими характеристиками. Мы оказались успешнее других, потому что предложили решение, обеспечивающее лучшее качество пучка", — отмечает Таскаев.
Еще одно ноу-хау — конструкция нейтроногенерирующей мишени. Наилучшим способом генерации эпитепловых нейтронов физики считают бомбардирование протонами ядер лития. Однако долгое время полагали, что изготовить мишень из металлического лития невозможно из-за его мягкости, низкой температуры плавления и высокой химической активности. Поэтому использовали бериллий-9 и углерод-13. Но с ними пучки заряженных частиц должны быть намного мощнее. Сибирские ученые первыми в мире успешно применили в установке для БНЗТ литиевую мишень.

© ИЯФ СО РАН
Ускорительный источник нейтронов для БНЗТ в лаборатории ИЯФ СО РАН
Эксперименты на крупных млекопитающих
В прошлом году исследователи института совместно с коллегами из Новосибирского государственного университета (НГУ) представили результаты уникального эксперимента по лечению домашних животных со злокачественными опухолями. Кошкам и собакам вводили борсодержащий препарат и облучали на ускорительном источнике нейтронов. Все делали in vivo, то есть непосредственно на организмах.
"За полвека по всему миру провели достаточно много экспериментов, но до сих пор не было исследований на крупных млекопитающих. В этом мы абсолютные лидеры, — подчеркивает заведующий лабораторией ядерной и инновационной медицины физического факультета НГУ кандидат медицинских наук Владимир Каныгин. — Уже более трех десятков животных прошли лечение с БНЗТ".

© Владислав Стрекопытов
Заведующий лабораторией ядерной и инновационной медицины физического факультета НГУ Владимир Каныгин
"Терапия в целом показала высокую эффективность на таких образованиях, как меланома, глиобластома, опухоли различной локализации, в том числе в стадии метастатического поражения отдаленных органов и систем, — продолжает ученый. — Причем как на традиционных, так и на вновь разрабатываемых препаратах. Поскольку обмен веществ в опухоли быстрее, чем в организме, соответственно, и накопление препаратов избыточное. И чем злокачественнее образование, тем эффективнее метод".
Каныгин уточняет, что экспериментировали только со спонтанными опухолями (а не привитыми, как у лабораторных мышей). У кошек и собак, как правило, те же виды рака, что и у человека, поэтому данное исследование можно рассматривать как доклиническое тестирование перед испытаниями на людях.

© ИЯФ СО РАН
Доклинические испытания технологии БНЗТ на животных
От идеи до клиники
Наиболее активно БНЗТ развивают в Японии. С 2020-го там лечат рак с помощью ускорительных источников нейтронов в двух медицинских центрах. В Китае с октября 2022-го продолжаются клинические испытания в больнице города Сямынь на установке, разработанной совместно ИЯФ СО РАН и компанией TAE Life Sciences (США). В декабре к исследованиям на людях приступили в Южной Корее.
В России действует государственная программа по переводу ускорительного источника нейтронов, построенного в ИЯФ СО РАН, в клиническую фазу. К середине 2024-го специалисты института должны изготовить и отправить источник в Национальный медицинский исследовательский центр онкологии имени Н. Н. Блохина в Москве, где планируют доклинические и клинические испытания.
При этом впервые в одном исследовании проверят и оборудование, и новые соединения для адресной доставки бора, разработанные в России на замену дорогим импортным. Испытания должны завершиться в 2027-м, а к 2030-му БНЗТ станет доступна пациентам.
